CONTENIDOS
DETERMINACIÓN DE MAGNITUDES TERMODINÁMICAS DEL KNO3 A PARTIR DE SU SOLUBILIDAD EN AGUA A VARIAS TEMPERATURAS
Estudio de un equilibrio químico: solubilidad de una sal. Comprobación experimental de la relación solubilidad-constante de equilibrio-temperatura. Cálculo de la entalpía del proceso a partir de la pendiente de la ecuación que relaciona la constante de equilibrio con la temperatura. Determinación de otras magnitudes termodinámicas en función de la temperatura: energía libre y entropía.
Termómetro de 0 a 100 °C (de cero desplazado); Placa calefactora; 1Tubo de ensayo grande; Soporte; 2 Nueces;
2 Pinzas; Bureta de 25 mL; Rotulador indeleble; Vaso de pptado de 400 mL; Agitador; Espátula;
En esta práctica se calcularán las magnitudes termodinámicas DH, DS y DG, a partir de la solubilidad en moles/litro determinada en un intervalo de temperatura aproximado de 30 a 80ºC, para el siguiente proceso de disolución de una sal:
KNO3(s) + ac Û K+ (ac) + NO3 - (ac)
Es necesario realizar dos simplificaciones:
1) No se consideran los coeficientes de actividad de los iones presentes en disolución, ni la fuerza iónica.
2) Se toma como temperatura de equilibrio la temperatura a la que se hacen visibles los primeros cristales (que probablemente es algo menor que el valor real).
Una disolución se considera que ha alcanzado el equilibrio cuando el sólido se encuentra en contacto con su disolución saturada, o sea, cuando aparecen los primeros cristales. La solubilidad, s, de la sal (moles por litro) será la cantidad de sustancia contenida en la disolución en estas condiciones y se calcula a partir de la cantidad de sal pesada y el volumen de disolución.
La constante de equilibrio, K,. si no se consideran los coeficientes de actividad, será el producto de las concentraciones de los iones en dicha disolución:
K = [K+] [NO3-] = s.s = s2 (4.1 )
y puede usarse para calcular el incremento de energía libre de la reacción. a cada temperatura, usando la siguiente relación:
DGo = - RT In K (4.2)
donde T es la temperatura en Kelvin y R es la constante universal de los gases, expresada en J.mol-1.grado-1.
Los valores de K para cada temperatura, hallados con la ecuación (4.1) y representados frente a la inversa de la temperatura (ecuación de Van’t Hoff, 4.3), permiten obtener una línea recta, de cuya pendiente se calcula la variación de entalpía, DHo, que para un pequeño rango de temperatura es un valor prácticamente constante.
In K = - DHo/(R.T) + cte (4.3)
Los valores de DGo, para cada temperatura, obtenidos a partir de (4.2), y el de DHo obtenido de la representación gráfica, permiten calcular la variación de entropía DSo, utilizando la ecuación:
DGo = DHo -TDSo (4.4)
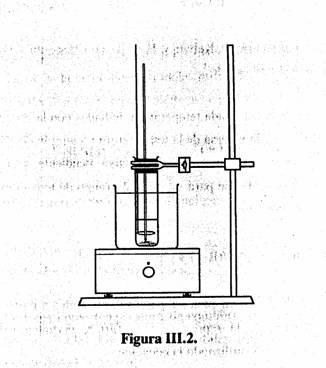
1) Pesar en un tubo de ensayo 10,0 g de KNO3. Montar el aparato como se observa en la Figura III.2. El termómetro se ajusta al tapón de manera que el bulbo quede dentro de la disolución, aproximadamente a 2 cm del fondo del tubo de ensayo. El asa del agitador debe estar alrededor del bulbo. Añadir desde la bureta 7,0 mL de agua al tubo de ensayo. Cerrar el tubo con el tapón y con el termómetro en su interior .
2) Calentar esta mezcla al "baño maría" hasta disolución completa agitando constantemente.
3) Sacar el tubo del baño, dejando que se enfríe mientras se agita de forma continua para evitar así la sobresaturación. Desconectar la placa calefactora.
4) Anotar la temperatura a la que aparecen los primeros cristales. Se asume que ésta es la temperatura de equilibrio.
5) Determinar el volumen de la disolución formada a la temperatura de aparición de los cristales. Para ello, se señala con el rotulador el nivel del líquido en este momento. Cuando se acabe la experiencia mediremos qué volumen hay en este momento.
6) Confirmar la temperatura de aparición de los primeros cristales volviendo a calentar el tubo hasta una nueva disolución, dejándolo enfriar otra vez, siempre sin dejar de agitar .
7) Añadir a la disolución anterior 3,0 mL de agua destilada, y calentar hasta que todo el sólido se haya disuelto. Volver a determinar el volumen de la disolución y la temperatura de equilibrio, tal y como se señaló anteriormente.
8) Repetir el ciclo 5 ó 6 veces, añadiendo 3,0 mL de agua destilada hasta que el punto de cristalización esté próximo a la temperatura del laboratorio.
9) Llegado este momento vaciamos el tubo de ensayo, lo enjuagamos bien y lo secamos con papel de filtro por dentro (cuidando no borrar las señales de rotulador), colocándolo de nuevo tal y como lo teníamos durante la experiencia. Llenamos la bureta con agua destilada y la situamos encima del tubo de ensayo, de modo que podamos ir añadiendo agua sin pérdida alguna. Añadimos agua desde la bureta hasta que el nivel del agua en el tubo alcance la primera señal de rotulador que habíamos hecho. En este momento cerramos la bureta y leemos en ella la cantidad de agua añadida. Ese volumen se corresponderá con el volumen de la disolución correspondiente a la primera temperatura tomada. Como sabíamos el número de moles de KNO3, ya podemos calcular la solubilidad.
A continuación seguimos añadiendo agua hasta alcanzar la segunda señal que habíamos hecho con el rotulador, de modo que al llegar a ella leemos el volumen total de agua añadido y podemos así determinar el volumen de la segunda disolución con la que trabajamos. Se procede de esta forma hasta determinar todos los volúmenes de las distintas disoluciones que preparamos anteriormente y que se corresponden con las diferentes temperaturas de equilibrio establecidas en la experiencia.
¡¡¡Asegurarse de que en todos los casos tenemos agua suficiente en la bureta como para no llegar a la parte que no está graduada!!!

Elaborar la siguiente tabla realizando todos los cálculos necesarios:
V (mL) T (K) 1/T (K-1) s (mol.l-1) K ln K
Representar gráficamente In K frente a 1/T , y determinar DHo a partir de la pendiente de la recta que se obtiene de esta representación.
Calcular los valores de DGo y de DSo para cada temperatura e incorporarlos a la tabla.
Cuestiones
1) A partir de la gráfica, determinar la solubilidad del nitrato potásico a 35 y 60 °C.
2) Comentar el significado físico de los valores obtenidos (principalmente el signo) de DHo, DGo y DSo.
3) ¿Qué función tiene el baño de agua que se usa en la práctica? ¿Se podría aplicar calor directamente al tubo de ensayo donde se realiza la disolución?